突破性微流控平台实现一站式类器官培养与高内涵成像
2025-12-05 07:47:07 来源:麦姆斯咨询 评论:0 点击:
类器官(Organoids)是一种能够模拟组织特征的微型化三维(3D)结构。为了研究类器官的发育、细胞异质性和药物反应,需要能够在同一平台内实现培养、染色和快速高内涵成像(HCI)。传统类器官的基质胶穹顶培养存在一个重要挑战,即类器官的随机分布使其远离成像基质。为了捕捉所有类器官,用户需要通过耗时的方法利用大量视场(FoV)对整个穹顶体积进行成像。此外,当在多孔板中接种成体干细胞来源的类器官(ASO)时,与孔壁的接触常常导致类器官停留在边缘,从而在孔中产生畸变和不均匀的类器官分布。这两个问题都需要将类器官转移到具有薄基底的次级平台进行高分辨率成像。然而,转移类器官会带来许多缺点和挑战。此外,当从基于水凝胶的细胞外基质(ECM)中释放出来时,类器官无法完全固定以进行基于成像的检测分析。在用于高通量筛选的快速成像过程中,由于显微镜载物台的移动或成像孔中试剂的流动,未完全固定的类器官可能会漂移,从而导致图像模糊。
迄今,已有研究提出多种新型装置用于ASO的平台上培养和成像,但它们仍然在不同程度上受到上述限制的影响。尽管这些装置能更好地控制ASO的空间分布,但许多装置缺乏薄基底,或者需要复杂的系统才能进行高分辨率成像。
据麦姆斯咨询介绍,为了应对上述挑战,美国得克萨斯大学奥斯汀分校的研究团队努力解决了六大关键问题,以开发一种高效的培养和成像平台,实现ASO的高通量和高内涵成像(HCI),具体包括:(1)无转移培养、免疫荧光染色和高分辨率成像;(2)类器官在Z轴方向的位置跨度有限;(3)预设类器官位置,以实现高通量检测;(4)类器官完全固定;(5)用于高分辨率成像的扁平、超薄基底;(6)可扩展且经济高效的高通量筛选设计。为此,研究团队设计了一种新型类器官芯片OrganoidChip+,以满足高内涵成像的六大关键需求。相关研究成果已经以“A microfluidic platform for culturing and high-content imaging of adult stem cell-derived organoids”为题发表于Scientific Reports期刊。
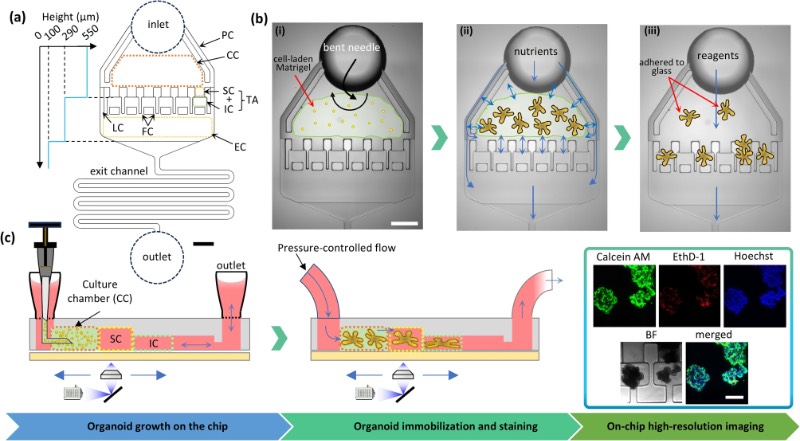
OrganoidChip+的尺寸和工作原理
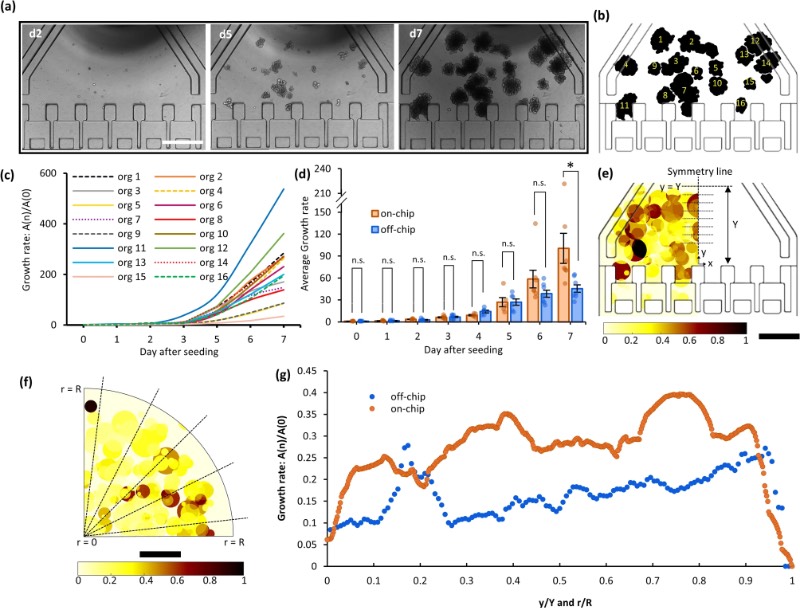
芯片外和芯片上培养的类器官的生长速率
OrganoidChip+由一个入口、一个培养室、两个侧面灌注通道、六个捕获区(TA)和一个用于产生流体动力学阻力的蛇形出口通道组成。培养室的高度限制在550μm,以促进类器官在薄玻璃基底附近生长,从而能够使用高数值孔径物镜进行高分辨率成像。
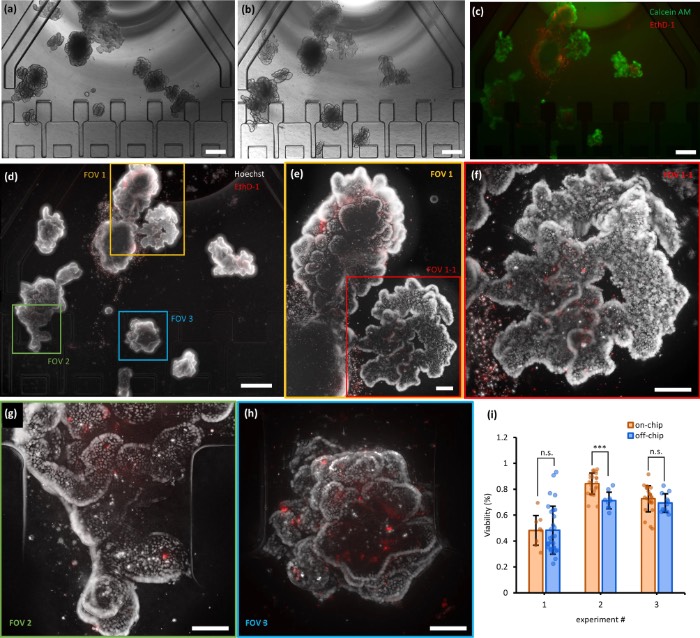
对在OrganoidChip+中培养的荧光标记类器官进行宽场成像
此前,类器官芯片作为一种成像工具,其捕获区用于类器官固定和高分辨率成像。在本研究中,研究人员通过实现类器官的芯片上培养,增强了芯片的功能。改进后的芯片设计在培养室两侧各设有一个灌注通道,以确保试剂更均匀地输送到培养的类器官中。芯片上培养的类器官的平均生长速率与多孔板中片外培养的类器官相当,表明该器件为ASO提供了良好的培养环境。
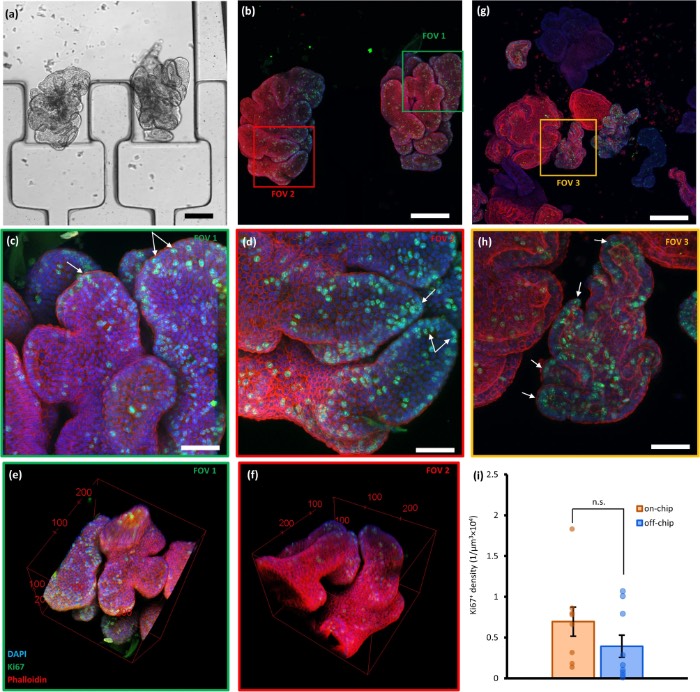
类器官在芯片外与芯片上培养、生长及免疫荧光染色后获取的荧光共聚焦图像
类器官培养之后,研究人员利用高分辨率成像在芯片上实施了三种基于图像的检测分析,包括类器官活力检测、利用无标记双色双光子显微镜进行的氧化还原比率评估,以及利用共聚焦显微镜进行的免疫荧光检测。这些研究通过实现培养、无转移染色和高分辨率成像,展示了较高的细胞活力、氧化还原比率以及相关的细胞表型。研究人员预计,OrganoidChip+将通过在一个平台上实现类器官的实时监测和单个类器官的高内涵终点分析,在类器官研究中发挥关键作用。
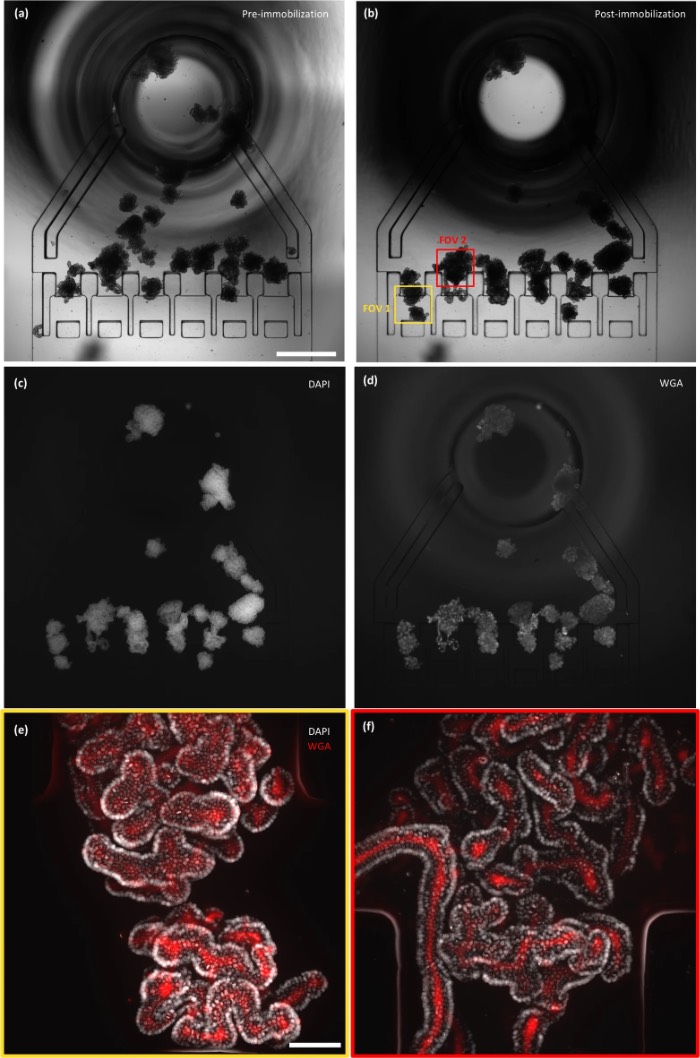
在同一芯片内培养、固定并经DAPI和WGA染色的类器官高分辨率图像
这些进展之所以能够实现,得益于OrganoidChip+的特殊设计,该设计完全满足ASO成功进行高内涵成像的要求。该芯片的设计包含多个关键特征,相比现有技术具有明显优势。最值得注意的是,它通过将类器官固定在六个捕获区域内,在类器官从基质胶中释放后实现了完全固定,以防止成像过程中的任何移动和模糊。捕获区域还为类器官提供了预定位置,使显微镜载物台能够自动定位,从而实现快速图像采集。成功进行高内涵成像的另一项关键设计考量,是确保与高分辨率显微物镜的光学和几何兼容性。为此,该芯片采用了薄玻璃基底和低高度培养室,以尽量减少所需的Z轴图像数量。此外,研究人员选择了100μm的最小通道尺寸,以兼容具有成本效益的大规模制造方法,例如采用塑料的注塑成型。使用塑料而非PDMS可消除PDMS的吸收特性,这种特性可能会干扰测试结果,尤其是在处理小疏水分子时。
未来的进一步研究,OrganoidChip+可以扩展为24孔或48孔格式,并采用标准的SBS尺寸制造,以支持高通量研究。将多个不同类型ASO的芯片相互连接,有望构建出具备自动化流体处理和成像能力的多器官芯片系统。随着这些增强功能的全面实现,预计OrganoidChip+将成为在类器官培养、染色、固定和高内涵成像方面极具竞争力的平台。OrganoidChip+能够在单一集成系统中支持类器官端到端的分析,这一特性将使其成为基础研究和转化应用中极具价值的工具。
论文链接:https://doi.org/10.1038/s41598-025-23883-2
延伸阅读:
上一篇:突破AI芯片散热瓶颈,微流控技术大幅提升冷却效率
下一篇:最后一页
