机器学习驱动的微流控电生理平台,实时分析并调控肿瘤-神经相互作用
2026-01-11 15:16:46 来源:麦姆斯咨询 评论:0 点击:
理解肿瘤与神经的相互作用,对于揭示驱动胶质瘤进展和侵袭性的机制至关重要。最近的研究表明,肿瘤细胞的电生理特性,例如膜电位和离子通道活性,是增殖、迁移和侵袭的核心调节因子。这些特性是肿瘤微环境不可或缺的一部分,通过调节离子通透性和信号转导影响癌症行为,导致异常的膜极化。因此,离子通道代表着有前景的治疗靶点,因为它们通过膜电位和细胞周期检查点的离子稳态来控制增殖,而钙激活钾通道(BK)与胶质瘤的分级和生长相关。胶质母细胞瘤表现出病理性的离子通道重编程,包括Kir4.1的丧失和BK的上调,约90%的离子通道突变通过破坏分化和增强可塑性与侵袭性表型相关。离子通道和泵的突变在胶质母细胞瘤中很常见,会促进高增殖、高迁移和高侵袭性。
肿瘤电生理学尤其引人注目的方面,是神经元与胶质瘤细胞之间的双向相互作用。神经元活动通过突触整合和神经营养因子的释放促进胶质瘤进展,因为胶质瘤细胞能够在结构和电学上融入神经回路。神经元通过神经兴奋、旁分泌信号传导以及直接的突触连接来调节胶质瘤的恶性程度。在治疗方面,针对这些通路的治疗显示出前景。尽管取得了一定进展,当前的研究工具仍缺乏足够的分辨率和多功能性,无法系统地研究神经元与肿瘤之间的复杂相互作用。
据麦姆斯咨询介绍,中山大学的研究团队提出了一种由机器学习驱动的微流控电生理平台,能够实时分析和调控肿瘤与神经的相互作用。该系统将微流控精度与计算建模相结合,对复杂的电生理信号进行解码和操控,以揭示胶质瘤与神经元通信的高分辨率动态。该方法能够识别出被胶质瘤细胞劫持以促进高侵袭性行为的特定神经回路,并发现了与这种侵袭状态相关的独特电生理特征。此外,研究人员还证明在体外重现这些特征能够重现肿瘤表型,这支持了神经元与胶质瘤之间的双向信号传导比单独的神经活动对侵袭性影响更大这一假设。相关研究成果已经以“A Machine Learning-Driven Electrophysiological Platform for Real-Time Tumor-Neural Interaction Analysis and Modulation”为题发表于Nature Communications期刊。
平台设计与表征
该研究提出了一种机器学习驱动的微流控电生理平台,该平台整合了定制微流控技术与复杂神经-肿瘤信号动态的实时解码。该平台架构由五个具有特定功能的不同层级组成:(1)信号采集硬件层,配备用于捕获神经和肿瘤电生理活动的微电极阵列(MEA),并搭配用于精确电调制的刺激装置;(2)数据收集与处理层,对原始信号进行滤波、去噪和标准化(通过频谱分析和波形表征处理127060个信号),以提取肿瘤-神经的时空相关性;(3)机器学习层(LSTM架构),采用双LSTM层(各含128个单元), 随机失活率为0.3,用于解码局部/全局时间依赖性,通过信号预测和分类实现模式识别;(4)调节与干预层,识别神经信号劫持事件并实施实时反馈控制;(5)可视化与监测层,通过集成成像和荧光染色提供肿瘤侵袭和神经活动的动态跟踪。通过将微流控技术、微电极阵列、实时分析和闭环干预相结合,该平台为解析肿瘤-神经串扰提供了一体化解决方案。
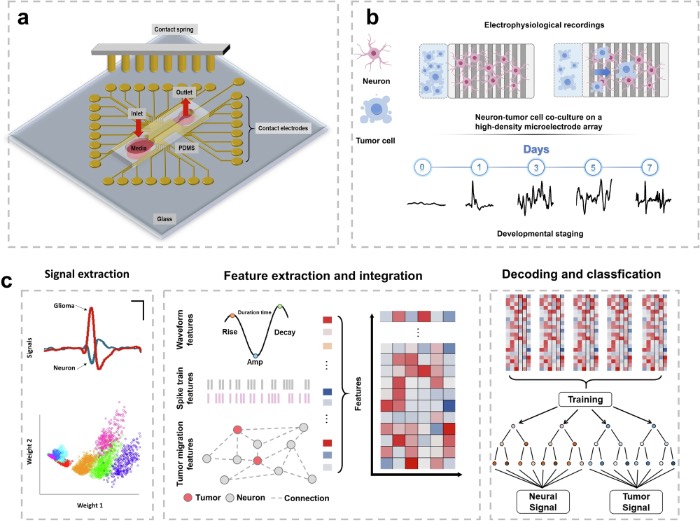
微流控MEA组件的设计和机器学习分类
微流控MEA集成了多个关键组件,用于精确分析肿瘤-神经相互作用。首先,双通道灌流入口和出口能够实现动态营养输送和废物清除,在模拟生理微环境的同时维持长期共培养稳定性。其次,具有空间优化接触点的高密度MEA布局确保了对肿瘤-神经界面区域的实时电生理记录,能够捕获局部场电位(LFP)和单细胞尖峰活动。肿瘤和神经系统最初被限制在分离的区域,微通道能够在7天内实时监测肿瘤对神经网络的侵袭。在此期间获得的电生理记录显示出与肿瘤和神经细胞相互作用不同阶段相对应的独特模式。该平台利用深度学习技术,实现了用于信号识别的特征特异性加权,并通过基于LSTM的动态相互作用映射分析肿瘤侵袭与神经活动之间的时空相关性。
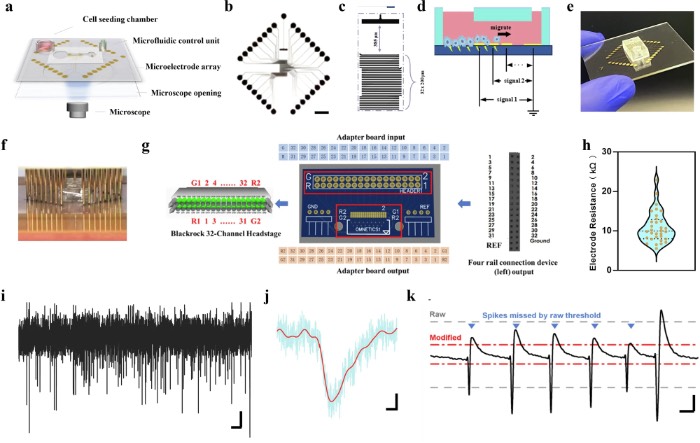
用于实时监测肿瘤-神经相互作用的微流控电生理平台
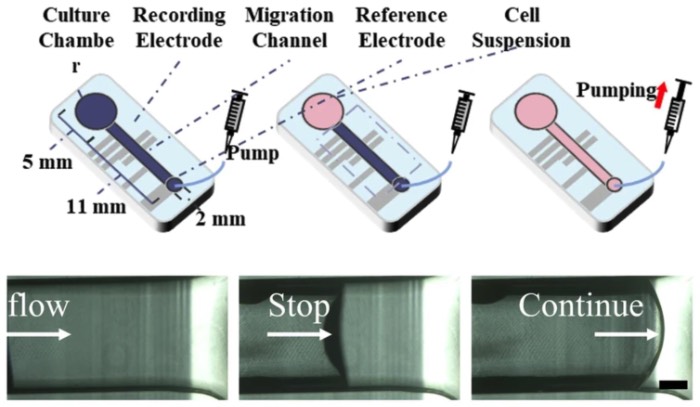
一种气动微流控系统,旨在神经环境中持续诱导胶质瘤细胞侵袭,该系统由主腔室、微通道、气泵接口和气泵组成
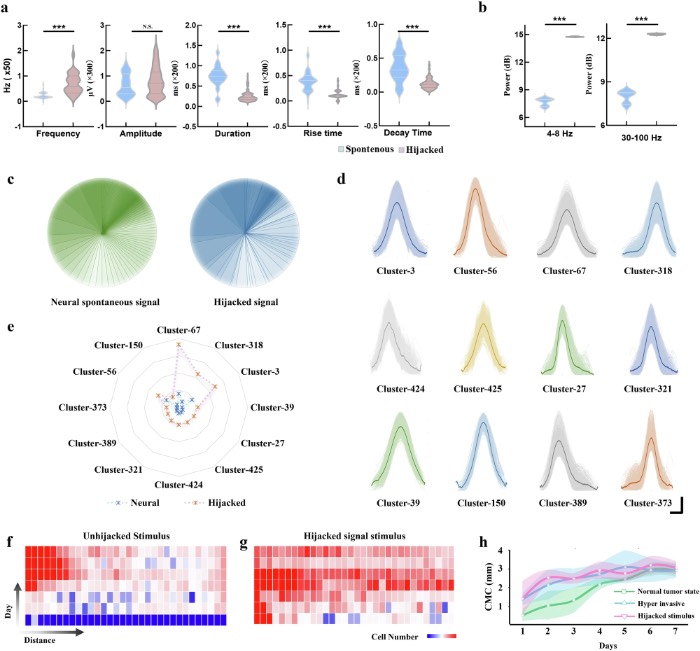
被劫持的神经信号在没有直接神经参与的情况下驱动肿瘤的高侵袭性行为
总之,该研究提出了一种机器学习驱动的微流控电生理平台,该平台整合了定制微流控技术与神经肿瘤复杂信号动态的实时解码。研究结果表明,胶质瘤细胞会选择性劫持特定的神经信号子集,重塑波形特性,并使其放电事件与神经活动同步。这种动态相互作用在增强胶质瘤侵袭性方面起着关键作用,因为肿瘤细胞会利用神经活动来促进自身进展。值得注意的是,在没有直接神经参与的情况下,用这些被劫持的信号模式靶向刺激胶质瘤细胞,就足以诱导其高侵袭性行为,这凸显了这些电信号作为肿瘤侵袭性驱动的作用。
该平台通过协同硬件设计和计算分析,解决了肿瘤电生理学中的“信号模糊”问题。解析肿瘤与神经元在“何时何地”发生电相互作用的能力,为识别侵袭路径中的生物电检查点开辟了新途径。所开发的基于气动的微流控电极阵列系统,有助于对胶质瘤细胞迁移进行持续追踪,使我们能够观察到与神经元和胶质瘤细胞同步放电事件相关的大量细胞运动。
论文链接:https://doi.org/10.1038/s41467-025-66988-y
延伸阅读:
上一篇:新型微柱阵列微流控平台,实现DNA凝聚体的精准可控
下一篇:最后一页
