新型微流控自由流等电聚焦平台,实现生物颗粒的精确、无标记分离
2025-09-18 13:30:54 来源:麦姆斯咨询 评论:0 点击:
自由流电泳(FFE)是一种连续、无凝胶的分离技术,当施加垂直于流体流动的电场时,不同带电分子或颗粒因为电泳迁移率不同而被分离。自该技术开发以来,自由流电泳的重要价值已被证明,得益于其保持天然构象及无标记的特性,可以用于分离多种生物分子和颗粒,包括核酸、肽、蛋白质和细胞器等。与批处理式电泳方法相比,自由流电泳具有连续运行、可扩展通量以及与上下游过程直接集成的独特优势。
在众多自由流电泳模式中,自由流等电聚焦(FFIEF)具有显著优势,该技术利用分析物的等电点(pI),即分子净表面电荷为零的特定pH值,实现复杂生物混合物的高分辨率分离。在pH梯度中,分析物在酸性区域带有正电荷,在碱性区域带有负电荷。这种电荷极性导致分析物在电场作用下向相反电荷的电极迁移,直到它们到达局部pH值与其pI匹配的区域,其电泳迁移停止。这种机制能够对表面电荷仅有微小差异的分子进行高分辨率分离。由此,FFIEF可广泛应用于蛋白质组学、代谢组学以及其它各种生物分析工作流。
然而,传统宏观FFIEF平台存在许多严重局限,包括样品消耗过多(数百微升或更多)、焦耳热引起的对流、不可控的流动形态以及面向即时诊断或便携式诊断较差的可扩展性。为了克服这些缺点,微流控FFIEF(μ-FFIEF)系统正作为一种合适的替代方案而受到越来越多的关注。这些微型化平台利用了微流控技术的固有优势,包括精确的微流体控制、最小化试剂用量、增强的散热性能以及与传感器和执行器的芯片集成等。不过,μ-FFIEF系统仍未得到广泛应用,因为它们还无法可靠地在微通道中生成并维持稳定的线性pH梯度。
目前大多数μ-FFIEF系统采用载体两性电解质(CAs),即在电场下自组装形成平滑pH梯度的两性缓冲剂。尽管CAs有效,但它们价格昂贵,并且会干扰检测(尤其是采用质谱和紫外吸收的检测),还可能与分析物发生不可预测的相互作用,从而降低分辨率和重现性。为解决这些限制,业界提出了多种无两性电解质的策略。
其中,基于电解的方法利用在相反电极处产生的H⁺和OH⁻离子来建立pH梯度。这些系统可以通过电极驱动的离子注入形成近乎线性的pH梯度,并已成功应用于无需CAs的蛋白质分离。然而,这种直接电极接触方法常常导致气泡形成、电极污染和pH曲线的不稳定,严重限制了系统的长期运行。虽然这些系统从概念上来说很有前景,但通常分辨率有限,且缺乏对流体动力学的精确控制。
近年来,离子选择性膜作为一种有前景的替代方案逐渐兴起。这些膜通过允许选择性离子传输(尤其是质子),同时从主分离流物理隔离氧化还原反应,实现了电化学驱动、无两性电解质的pH梯度。这种方法最大限度减少了气体产生和电化学反应副产物,从而提高了梯度稳定性和操作鲁棒性。不过,迄今为止,大多数基于膜的μ-FFIEF平台仍然停留在概念验证阶段,或仍未在制备环境中使用真实生物分析物进行验证。
据麦姆斯咨询报道,韩国浦项科学技术大学的研究人员开发了一种新型μ-FFIEF平台,无需使用Cas,通过图案化Nafion离子交换膜注入质子来生成连续且稳定的pH梯度。相关研究成果已经以“Ampholyte-free microfluidic free-flow isoelectric focusing via ion-exchange membranes for particle separation”为题发表于Analytica Chimica Acta期刊。
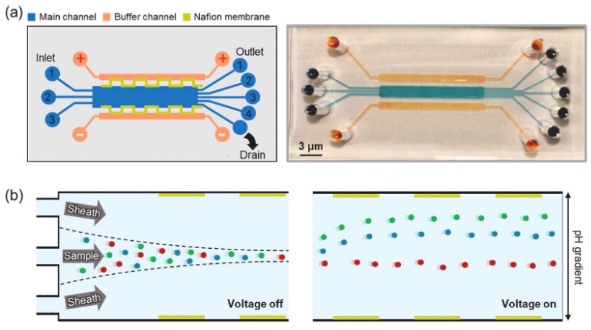
无两性电解质μ-FFIEF及其工作原理
研究人员通过系统优化表明,该μ-FFIEF平台在90 V和15 μL/min流速的最佳条件下,可形成pH 2~9的稳定pH梯度。电流在超过60分钟的运行中保持稳定,证实了该装置的电学和运行稳定性。在此优化条件下,三种代表性分析物(荧光聚苯乙烯颗粒、大肠杆菌和mRNA-脂质纳米颗粒),根据其不同的pI成功分离。Zeta电位分析和荧光强度分布证实了分离的空间分辨率和可重复性。这些结果证实,该μ-FFIEF平台能够基于其电化学特性实现生物相关颗粒的精确、无标记分离。
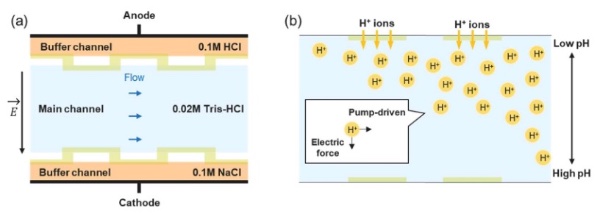
无两性电解质μ-FFIEF器件中的pH梯度生成示意图
总体而言,本研究提出的μ-FFIEF平台具有连续运行、样品需求量小以及与真实生物样品兼容的特点,为制备型生物分析和芯片实验室分析工作流的集成提供了巨大潜力。其无需Cas的设计通过减少对光谱或质谱检测的干扰,有效促进了下游分析。
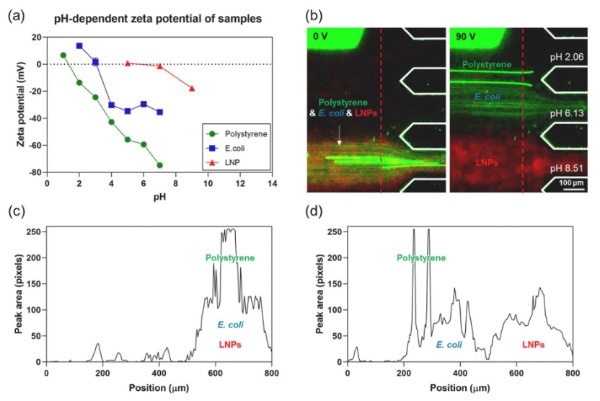
通过所提出的μ-FFIEF平台,基于pI实现生物颗粒的精确、无标记分离
论文链接:https://doi.org/10.1016/j.aca.2025.344567
延伸阅读:
相关热词搜索:微流控
上一篇:集成电化学传感器的数字微流控平台,自动化提取并检测细胞外囊泡
下一篇:最后一页
