开放式微流控全血细胞功能检测平台,可用于巴贝虫感染动态监测
2025-08-24 22:33:31 来源:麦姆斯咨询 评论:0 点击:
巴贝虫(Babesia microti)是一种属于顶复门的原虫寄生虫,它感染并损害动物和人类宿主的红细胞(RBCs),为人体健康带来重大负担,尤其对于免疫功能低下的人群。尽管对该寄生虫引起的疾病已有一定的认识,但由于对寄生虫非常规宿主周期、发病机制、耐药性和复发以及新突变物种的出现缺乏全面了解,巴贝虫病例近年仍在持续上升。与其它红细胞寄生虫不同,巴贝虫利用不同长度的宿主周期,在恶劣环境中获得生存优势。然而,我们对巴贝虫在传播和感染过程中所采用的机制仍知之甚少。
为了开发新的感染干预策略(包括预防和治疗),需要更深入地了解感染动态以及寄生虫在宿主环境中的生物物理和化学机制。目前采用的体外分析方法仅能在特定时间点或通过离散的几个时间点对细胞或分子水平(例如抗体、DNA)的感染动态进行“瞬间快照”。此外,使用小鼠模型仍存在很多局限性,例如需要专门的设施、广泛的员工培训以及持续的维护费用等。
上述局限源于寄生虫在宿主系统外的可培养性差。一旦离开宿主,由于体内到体外微环境的改变,寄生虫表现出下降的增殖和传播能力。为减少实验室动物的使用,并能在体外持续监测感染动态,需要进行血液细胞功能检测,即在一个时间段内(例如数小时、数天或更长时间)检测寄生虫-宿主细胞的相互作用。理想情况下,血液细胞功能检测平台应该能够:(1)在类体内微环境中连续(数天)培养寄生虫,(2)空间时间样本操作,以及(3)在原位持续监测感染动态,并实时读取结果。
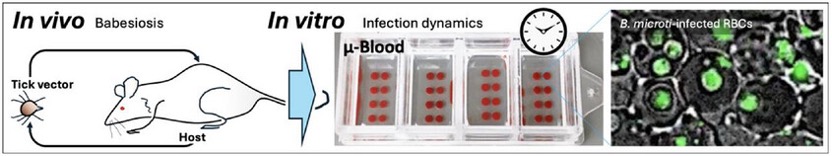
据麦姆斯咨询报道,卡内基梅隆大学和匹兹堡大学的研究人员开发了一种命名为µ-Blood的开放式微流控全血细胞功能检测平台。µ-Blood是基于排它性液体排斥(ELR)的一种油下开放式微流控系统(UOMS)。与其它微流控血液检测平台相比,µ-Blood具有以下特点:(1)直接使用未经处理的血液进行输入和检测(持续数天),保留原始的宿主特异性全血微环境,(2)简化操作步骤(即无需血液稀释或细胞分离),减少观察者引入的误差(如血液样本污染、血液中固有信号分子的损失),(3)可在器件上自由获取样本,且对系统干扰最小(例如,封闭式微流控中常见的颗粒/气泡堵塞,以及物理接触导致的不可逆损坏),(4)自主调节的氧气微环境(AROM),(5)多种/组合的光学检测方式(即相差显微镜、荧光/共聚焦显微镜、多光子显微镜、拉曼光谱、红外显微镜),(6)符合开放式系统标准和实验室自动化,以及(7)采用/实施门槛低。具体而言,µ-Blood通过去除血液细胞分离或全血稀释步骤,最大限度地减少了体内信息的损失和观察者引入的误差。

µ-Blood器件制造及操作流程
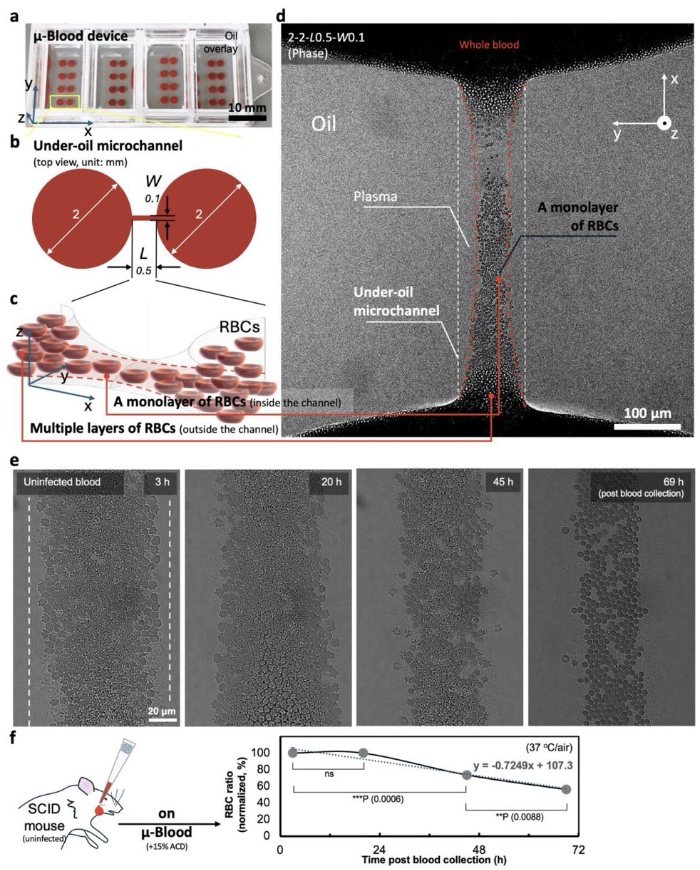
µ-Blood器件设置和油下全血检测微环境
在这项新研究中,研究人员利用µ-Blood技术对感染巴贝虫的SCID小鼠体内采集的全血样本进行了分析。研究人员验证了实验方案和体外培养4天感染动态的定量监测。具体而言,µ-Blood技术可支持:无标记(基于相差显微镜)的全血中巴贝虫的识别检测,更高精度的寄生虫血症测量,以及对巴贝虫感染红细胞动态的长期监测。这些结果表明,µ-Blood技术能够利用供体特异性、保存完好的全血微环境,在体外研究血液传播感染。相关研究成果已经以“In Vitro Monitoring of Babesia microti Infection Dynamics in Whole Blood Microenvironments”为题发表于Advanced Science期刊。
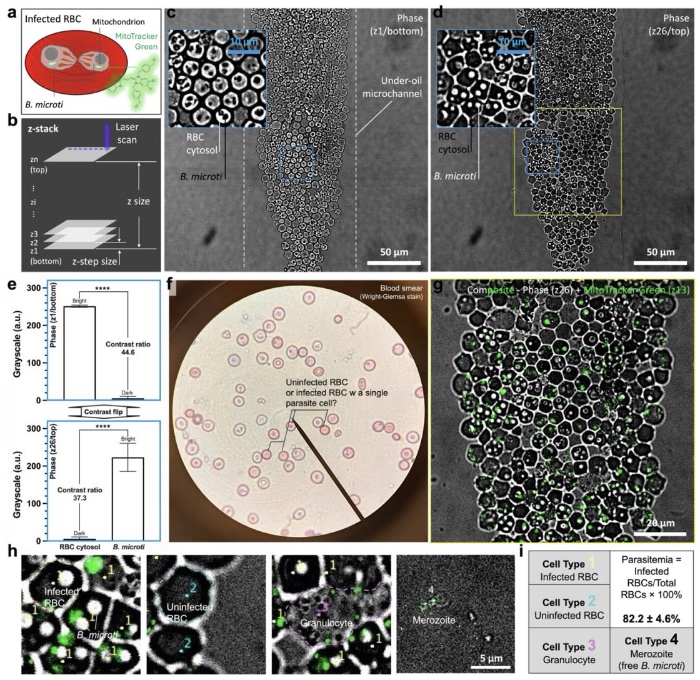
全血中识别巴贝虫,利用共聚焦成像进行寄生虫血症测量
通过保持宿主特异性全血微环境的完整性,µ-Blood为传统以实验室动物为中心的感染动力学研究提供了一种全新的体外解决方案。此外,µ-Blood与多种光学检测技术的兼容性,包括相差显微镜、落射荧光/共聚焦显微镜以及无标记显微光谱(例如拉曼光谱、红外光谱),增强了其在不同实验应用中的实用性。该平台的显著影响可能体现在需要精确延长实验来研究复杂血液寄生虫-宿主细胞相互作用的领域。具体而言,µ-Blood将有助于筛选各种难以培养病原体可培养性的体内变量,从而减轻或消除传染病研究中对实验室动物模型的严重依赖。
论文链接:https://doi.org/10.1002/advs.202508185
延伸阅读:
相关热词搜索:微流控
上一篇:无阀压电微泵结合微针阵列,实现高精度可穿戴经皮给药
下一篇:最后一页
