全柔性微流控神经接口,实现脑部无线按需给药
2025-08-11 22:00:25 来源:麦姆斯咨询 评论:0 点击:
随着人类对脑部疾病机制理解的不断深入,推动了针对脑肿瘤、神经退行性疾病(例如阿尔茨海默病和帕金森病)以及癫痫等病症的靶向药物治疗。尽管已经取得了一定的进展,但中枢神经系统(CNS)靶向药物的治疗效果仍然存在局限,难以在病灶部位达到并维持有效的药物浓度。其中的一个主要障碍是血脑屏障(BBB),它限制了大多数治疗药物(尤其是大分子),从体循环进入脑组织的通路。
为了克服这一限制,对流增强给药(CED)成为一种有前景的方法,它通过植入的探针将药物直接注入脑组织。通过局部给药,CED最大限度地减少了全身暴露,降低了脱靶效应。在此,微流控神经探针的应用越来越多,但传统设计通常依赖外部泵和管道,限制了它们在自由活动状态中的实用性,阻碍了长期体内研究。此外,连接系统还会影响神经药理学评估的保真度,凸显了对无线、无物理连接集成给药平台的需求。
针对这一挑战,业界已开发了多种基于微泵的集成探针。然而,传统的机械微泵通常依赖刚性材料和复杂组件进行驱动,难以顺应软组织环境。另外,与尺寸、材料兼容性和供电相关的局限仍然限制了它们在植入式给药系统中的应用。为了克服供电挑战,研究人员还研究了由射频、超声波或交变磁场等外部刺激驱动的微泵,然而,这些方法在脑内应用时仍面临关键限制,包括需要精确对准和较浅的有效穿透深度等。解决这些挑战需要创新的微泵设计,以增强与柔性神经探针的集成,实现流体动力学的精细控制,并在操作过程中最大限度地减少组织损伤。
据麦姆斯咨询介绍,韩国大邱庆北科学技术院和全北国立大学的研究人员近期报道了一种无线、微型化的神经探针,通过集成非对称锥形喷嘴-扩散器微流控通道的热气动蠕动式微泵,能够实现按需给药。该微泵的所有结构和功能组件全部由柔性材料制成,能够与柔软的脑组织无缝贴合。该微泵无需机械阀门,由内嵌微型加热器的局部焦耳热使弹性膜片变形以产生定向气流,实现蠕动驱动。这种设计不仅最大限度地减少了回流,还能够通过精确的无线控制实现可编程的药物释放。该系统能够按需递送可控体积的药物,支持空间和时间上可调控的输注。通过计算模拟以及模拟大脑的台式装置验证,证实了该系统在持续、实时药物输注方面的能力。研究结果表明,这种全柔性蠕动系统在下一代无物理连接神经药理学干预中具有应用潜力。
相关研究成果已经以“A soft neural interface with a tapered peristaltic micropump for wireless drug delivery”为题发表于近期的npj Flexible Electronics期刊。
无线热气动按需给药柔性神经接口
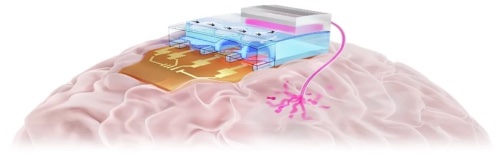
图1 植入大脑的无线热气动微泵示意图
图1示意性地展示了植入大脑的无线热气动微泵。该系统由一个无线控制模块和能够靶向深脑区域的集成微流控探针组成。通过系统内嵌的微型加热器进行局部焦耳加热实现无线驱动,无需外部连接。图2展示了所提出的热气动微泵的架构,包括三个功能层:嵌入微型加热器的泵送层(底部)、微流控层(中部)和药物储存层(顶部)。
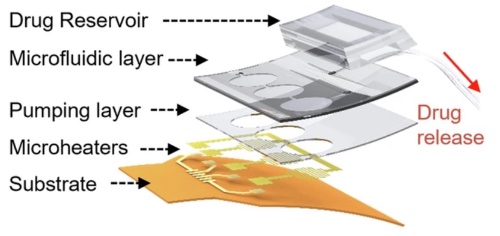
图2 热气动微泵的架构,包括药物储液器、微流控层、泵送层、微加热器和柔性基板
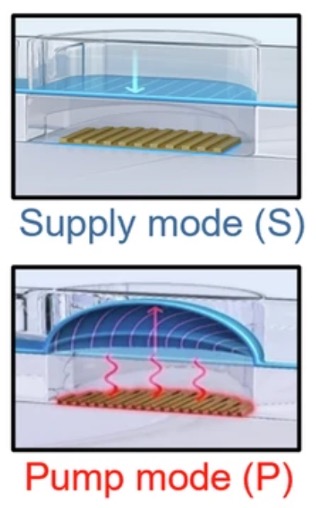
图3 微泵的工作原理示意图,通过微加热器加热和冷却控制膜片变形,在供给模式(S)和泵送模式(P)下产生气流
图3所示横截面结构突出了位于底部泵送层和顶部微流控层之间的蓝色膜片,在两种不同的工作模式:供给模式(S)和泵送模式(P)期间的形变。泵送层集成了微加热器阵列,该阵列根据局部温度变化调节膜片的形变。泵送模式是指可变形膜片在微加热器加热下向上弯曲的状态,而供给模式则是指膜片在冷却后恢复到原始位置的状态。上部的微流控层会根据膜片的状态吸入或排出空气。
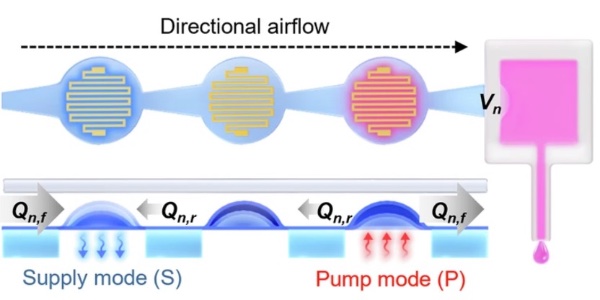
图4 具有三个腔室的微泵的顶部和横截面视图,用于产生蠕动运动。通过供给模式(S)进行流体吸入,通过泵送模式(P)进行流体泵送以实现药物递送
图4显示了微流控系统的顶部和横截面视图,该系统由三个微流控腔室组成。微加热器可以在“冷却”状态(没有电流流经加热器)和“加热”状态(电流流经加热器)之间切换。在冷却状态下,膜片收缩,使上层微流控层的局部体积膨胀并吸入空气。相反,在加热状态下,膜片膨胀,升高内部压力,在泵送模式下排出空气。
三个微流控腔室通过非对称锥形微通道相互连接,促进了单向流动,这也是相较于传统对称微通道的优势。该设计利用了喷嘴-扩散器结构,流体通过两个不同部分:喷嘴(收敛通道)和扩散器(发散通道)。在前进方向上,流体轻松通过喷嘴,随着横截面积变窄而加速并降低压力。对比之下,在相反的方向上,流体在扩散器部分遇到更大阻力,导致能量损失和流动受限。这种几何非对称性校正了流体运动,无需机械阀门,即可实现单向流动。研究人员模拟了非对称喷嘴-扩散器通道结构的气流,展示了在中间腔室供给模式下的定向气流,与对称通道通常呈现的双向行为形成对比。
非对称微流控通道设计优化
该微流控系统的一个关键特征是腔室之间非对称的锥形微通道。这些通道从入口至出口逐渐变宽,形成喷嘴-扩散器配置,通过流动阻力和动量差异实现单向气流。研究人员考量了几个影响药物递送性能的几何参数,其中最重要的是腔室半径(R)、通道宽度(W)和扩散器的锥形角度(θ)。
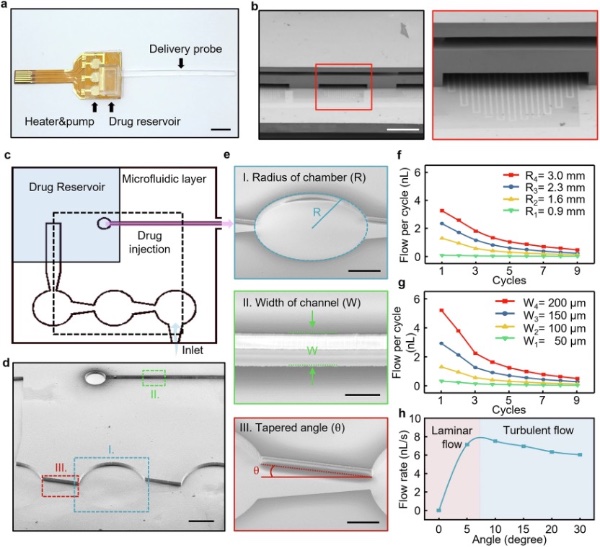
图5 柔性给药器件的结构,以及基于FEA分析的设计参数优化
研究人员研究了出口通道宽度的影响,表明更宽的通道能降低流动阻力,并在每个周期内实现更大的体积位移。同时,分析了连接通道锥角的影响。基于模拟结果,神经探针的优化几何参数设置为:腔室半径(R)1.5 mm,通道宽度(W)0.5 mm,锥角(θ)5°。
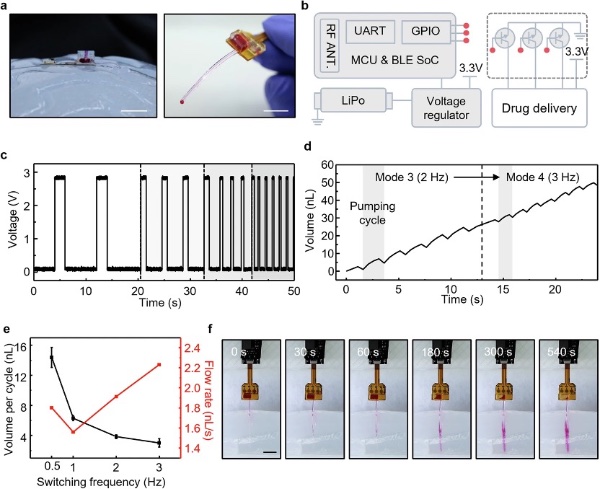
图6 在台式装置上对所制造的给药模块进行实验验证
总结而言,研究人员开发了一种完全柔性、无线的神经探针,通过集成非对称锥形喷嘴-扩散器微通道的热气动蠕动式微泵,能够实现按需、定向给药。该系统采用内嵌微型加热器进行顺序焦耳加热,无需机械阀门或外部管道,即可产生单向气流。
为了满足热气动驱动时空气输入的需求,药物储液器和控制电路位于外部头戴式装置中,无需开颅切口即可允许环境空气进入。研究人员通过计算模拟优化了流体性能,并在模拟大脑的模型中验证了设备功能。结果表明,所提出的方案能够实现一致、可编程的药物输注,并使回流最小化。
这项工作解决了传统神经药物递送系统中的几个关键限制,包括机械刚性、外部连接以及剂量不精确。通过结合无线控制、柔性集成和精确的流体驱动,该平台为无连接闭环神经药理学疗法提供了一条有前景的途径。
为了支持未来的体内应用,还有几个重要因素需要考量。在复杂的生物环境中长期运行可能会带来挑战,例如由于生物污染导致的通道堵塞,以及靠近敏感组织的热量积累。生物污染可以通过抗污染表面处理来缓解,这种处理可以改变PDMS通道壁固有的疏水性,使其更具亲水性,从而减少蛋白质和细胞的非特异性吸附。对于热管理,研究人员设想将驱动组件封装后放置在颅骨上,根据模拟,这将使温升限制在2°C以内,处在安全的生物限度内。
此外,其数字可编程驱动具有亚100 nL分辨率和无线设计,能够与生物信号采集系统集成,实现闭环和个性化给药。这使其能够根据癫痫和帕金森等疾病需求,进行实时、个性化的脑内剂量调节。鉴于这些考量,未来的研究将聚焦体内验证以及与实时生物传感器的集成,以实现针对慢性神经系统疾病的自主治疗反馈系统。
论文链接:https://doi.org/10.1038/s41528-025-00463-y
延伸阅读:
