胶原基3D生物打印全生物组织系统,有望用于糖尿病治疗
2025-04-28 21:43:29 来源:麦姆斯咨询 评论:0 点击:
心血管系统是所有脊椎动物的生存基础,它负责将氧气和营养物质输送到全身的组织和器官,并清除代谢废物。这种对可灌注微流体网络的需求,为生物工程领域带来了重大挑战,往往导致组织支架及器件的工程设计要么将厚度限制在被动营养物质扩散的极限(约200 μm),要么因缺氧而导致较大结构中的核心坏死。
解决上述问题的关键是开发微流控和器官芯片系统,以模拟血管流动和生物过程,包括肺器官芯片、微型心泵、多器官系统和三维血管网络。这些微物理系统已被证明是研究血管生成和血管新生的有用平台,也是模拟无法在患者体内研究的人类疾病和药物反应的重要平台。
然而,传统用于制造微流控芯片的材料都是塑料和弹性聚合物,例如聚二甲基硅氧烷(PDMS),其硬度比原生组织高出几个数量级,可能会吸收介质中的亲脂性生物分子。而且,它们需要光刻技术和无尘室来制造,无法被细胞重塑成更复杂的结构,且只能在体外使用。
利用水凝胶基材料构建可灌注支架已被认为是克服这些挑战并更好地模拟原生细胞外基质(ECM)的一种有效方法。使用聚丙烯酸酯等光敏树脂以及聚乙二醇二丙烯酸酯与明胶甲基丙烯酰胺等生物相容性水凝胶进行微流控器件的高分辨率3D打印可解决上述某些问题,但该方法通常仅限于单一材料,而且在器件制造后仍必须通过灌注播种进行细胞培养。同样,使用牺牲型聚合物挤压3D生物打印血管样网络能够制造出可灌注的组织结构,但空间分辨率和设计复杂性有限。因此,虽然已开发出多种制造技术,但在3D空间图案化细胞、水凝胶、ECM和其它成分方面仍存在局限,从而限制了可构建模型系统的结构复杂性和功能。
据麦姆斯咨询介绍,美国卡内基梅隆大学(Carnegie Mellon University)和匹兹堡大学(University of Pittsburgh)的研究人员利用悬浮水凝胶的自由可逆包埋(FRESH)3D生物打印技术,创建了首个完全由胶原蛋白构成的微生理系统(组织模型)。研究人员表示,这一进展拓展了研究疾病并构建组织用于治疗(例如Ⅰ型糖尿病)的能力。

卡内基梅隆大学生物医学工程和材料科学与工程教授Adam Feinberg博士解释说:“现在,我们可以在培养皿中完全用胶原蛋白、细胞和其他蛋白质构建微流控系统,其结构分辨率和保真度都达到了前所未有的水平。最重要的是,这些模型是全生物的,意味着细胞能更好地发挥作用。”
类胰腺组织
该研究成果已经以“3D bioprinting of collagen-based high-resolution internally perfusable scaffolds for engineering fully biologic tissue systems”为题发表于《科学进展》(Science Advances)。研究人员展示了如何利用他们的技术通过全生物材料构建更复杂的血管组织,以创建类胰腺组织,有望将来用于Ⅰ型糖尿病的治疗。
在这项研究中,研究人员将胶原基水凝胶、ECM和细胞直接3D生物打印成具有高保真结构及组成控制的全生物灌注式支架。为此,他们利用FRESH的多功能制造能力,将自上而下的可灌注水凝胶支架工程设计与自下而上的细胞驱动自组装相结合,在宏观(>1 mm)和微观(<1 mm)尺度之间架起了桥梁。

FRESH 3D生物打印CHIPS的制备、三维测量及灌注
具体来说,研究人员通过FRESH 3D生物打印技术将细胞、Ⅰ型胶原蛋白、纤维蛋白以及其他ECM成分和生长因子打印成复杂的3D结构,称为基于胶原蛋白的高分辨率内部可灌注支架(CHIPS)。作为人体的主要结构蛋白,Ⅰ型胶原蛋白具有机械强度并能确定血管和组织区室,是CHIPS结构生物打印的理想材料。此外,为了灌注这些相对柔软的胶原基支架,研究人员开发了一种新型生物反应器系统,称为血管和灌注器官芯片反应器(VAPOR),用于动态培养CHIPS。在计算机辅助设计(CAD)中快速迭代VAPOR和CHIPS的设计,并立即进行FRESH打印,形成了高度模块化的组织工程平台。研究人员通过制造并验证10多种不同的CHIPS设计进行了证明,其中包括葡萄糖响应型、胰岛素分泌型CHIPS,它们能在灌注培养下形成类似毛细血管的网络。微流控CHIPS和VAPOR生物反应器共同组成了一种集成系统,既能再现已有的微流控功能,又能实现新结构,将细胞与胶原蛋白及纤维蛋白等ECM蛋白结合,形成功能性的厘米级组织系统。
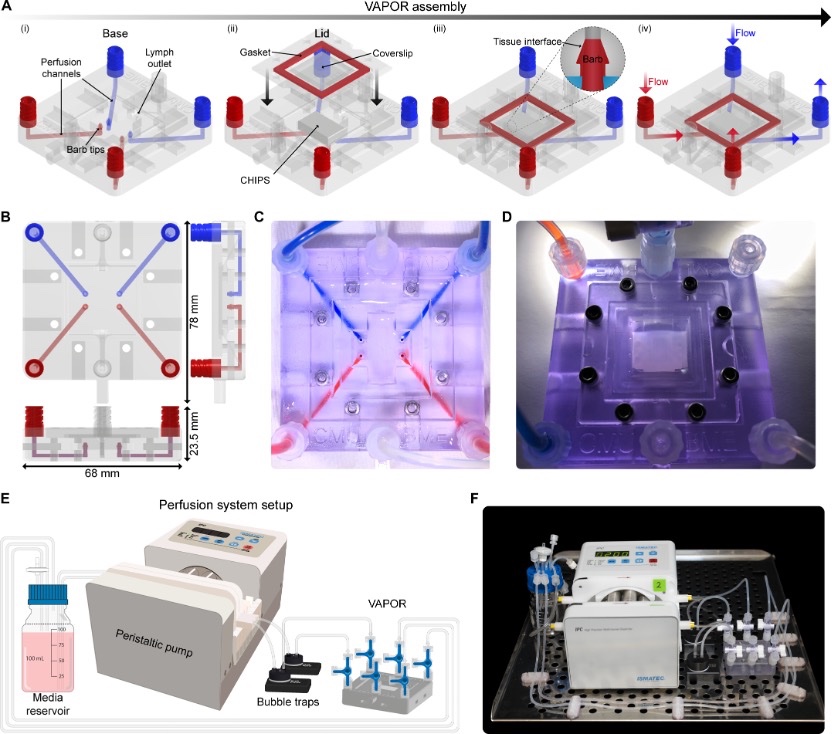
VAPOR生物反应器平台的设计与部署
匹兹堡大学生物工程助理教授、Feinberg实验室博士后研究员Daniel Shiwarski博士介绍说:“FRESH打印技术的几项关键技术发展促成了这项工作。通过实施单步生物打印制造工艺,我们制造出了基于胶原蛋白的可灌注CHIPS,其设计范围宽泛,超过了迄今为止任何其他已知生物打印方法的分辨率和打印保真度。”
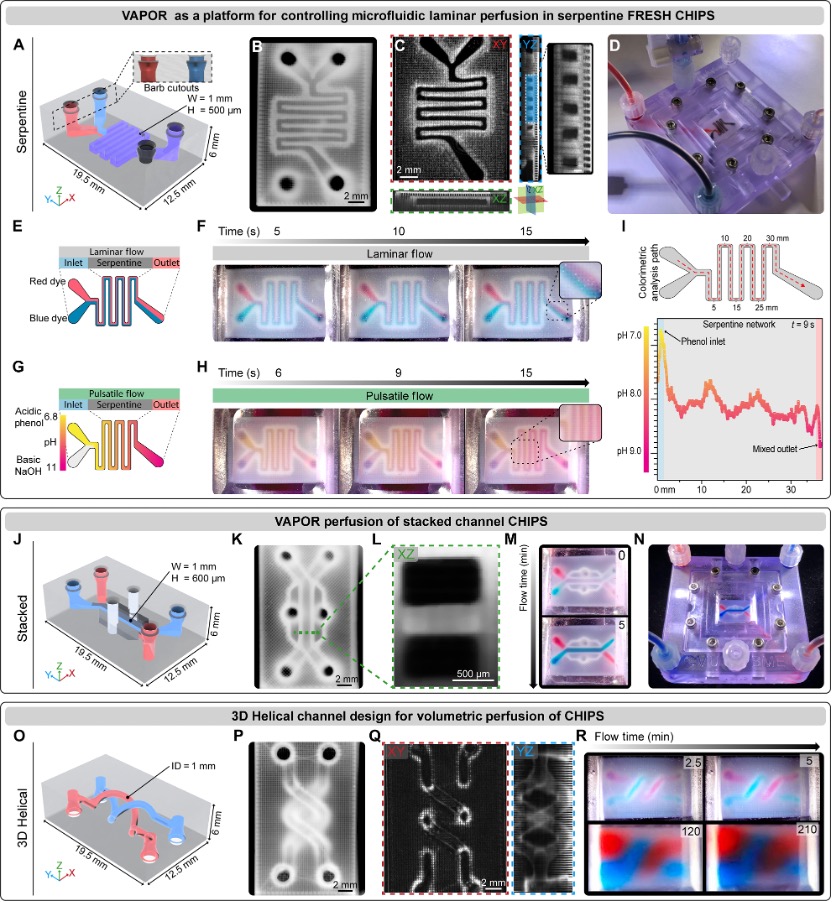
FRESH CHIPS的VAPOR灌注
当结合ECM蛋白、生长因子和含细胞生物墨水的多材料3D生物打印,并集成到定制的生物反应器平台中,能够构建厘米级的类胰腺组织结构,产生葡萄糖刺激的胰岛素释放,超越了目前其它基于类器官的方法。

研究小组展示利用全生物材料构建更复杂的血管化组织,制造出一种类胰腺组织,将来有望用于治疗Ⅰ型糖尿病
成果转化
这项技术目前正由从卡内基梅隆大学孵化的公司FluidForm Bio进行商业化,该公司组织治疗学主任、该研究共同作者Andrew Hudson博士及其团队已经在动物模型中证明,他们可以在体内治愈Ⅰ型糖尿病。FluidForm Bio公司计划在未来几年内开始对人类患者进行临床试验。
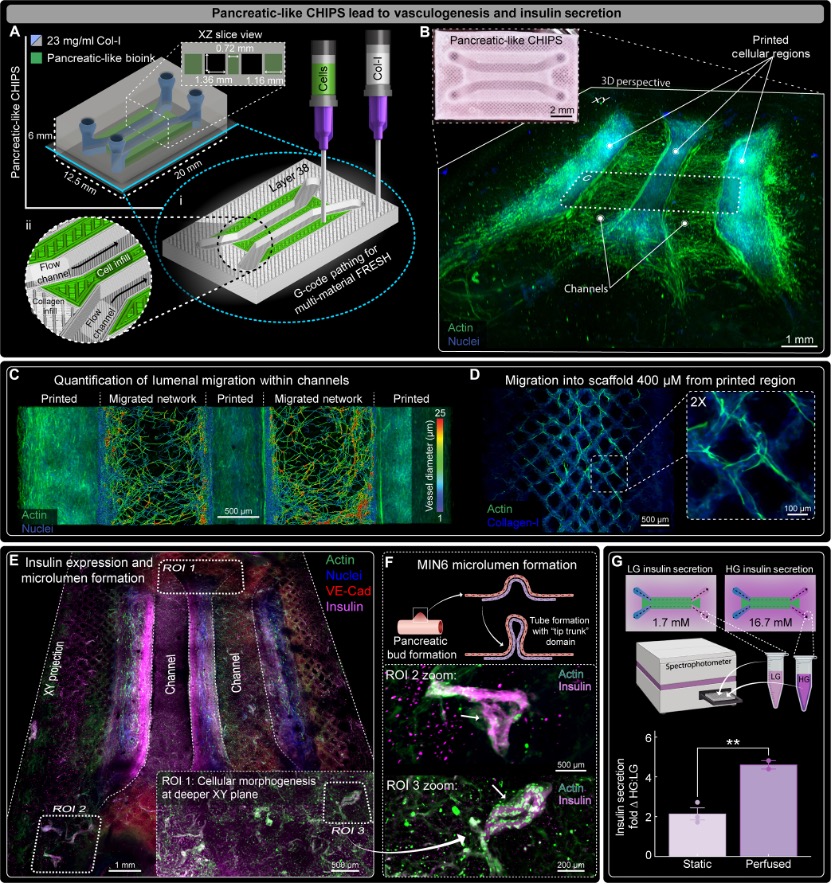
FRESH生物打印的血管胰腺CHIPS显示血管生成和胰岛素分泌
“展望未来,问题不是我们能否构建它,而是我们要构建什么。”Feinberg说,“我们今天所做的工作就是利用这种先进的制造能力,将其与计算建模和机器学习相结合,这样我们就有望更好地理解我们需要打印什么。最终,我们希望这种组织能更好地模拟所关注的疾病,最终具有正确的功能,这样当我们将其植入人体治疗时,它就能发挥我们想要的作用。”
Feinberg及其团队致力于发布开源设计和其他技术,以便在研究界广泛采用。
总之,CHIPS和VAPOR平台代表了3D生物打印技术的巨大进步,它将高分辨率FRESH打印与动态灌注系统结合起来,设计出复杂、功能性、厘米级的组织结构。这种方法实现了精确的3D多材料生物制造、直接区室细胞化、毛细管样网络形成以及组织级分泌功能,从而突破了组织工程学的极限。尽管挑战依然存在,如优化微流控通道分辨率、增强流动条件下的内皮稳定性以及完善体内整合,但该系统的灵活性和易用性为更广泛的应用和未来的创新铺平了道路。
论文链接:https://www.science.org/doi/10.1126/sciadv.adu5905
延伸阅读:
上一篇:综述:生物微系统中介电泳和电渗流的微电极设计与制造
下一篇:最后一页
