器官芯片技术帮助实现人体肠道微生物组的体外研究
2019-05-16 15:26:56 来源:麦姆斯咨询 评论:0 点击:
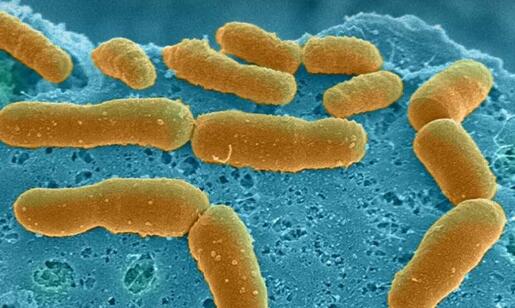
人体肠道微生物组(黄色)细菌填充了厌氧肠芯片的肠上皮通道,以维持肠道低氧浓度。细菌直接依附在由肠上皮细胞产生的致密粘液层上。
人体微生物组——存活在我们身体内部和体表的大量微生物,深深影响着人类的健康和疾病。特别是人体肠道菌群,其中含有数量最密集的微生物,不仅可以分解营养物质,释放对我们的生存至关重要的分子,而且也是多种疾病发展的关键因素,如感染、炎症性肠病、癌症、代谢疾病、自身免疫性疾病和神经精神障碍。
我们对人体微生物组相互作用的了解大多基于使用基因组或宏基因组分析,对粪便样本中所含的疾病状态和细菌DNA之间的相关研究。因为研究微生物组和人体外肠道组织之间的直接相互作用是一项艰巨的挑战,很大程度上是因为即使是共生菌在培养皿中培养一天时间也会过度生长并杀死人体细胞。肠道中的许多共生微生物也是厌氧的,因此它们需要非常低的氧环境才能生长,这种环境下的人体细胞则会受到损害。
据麦姆斯咨询报道,由哈佛大学威斯生物启发工程研究中心(Harvard's Wyss Institute for Biologically Inspired Engineering)创办主任Donald Ingber带领的研究团队,利用器官芯片微流控培养技术开发出了应对该问题的解决方案。他的团队现在能够在人体肠道芯片中培养一种稳定的复杂人体微生物组,可以与血管化的人体肠上皮细胞直接接触至少5天,芯片内建立了氧气梯度,为内皮细胞和上皮细胞提供高水平供养,同时维持共生菌居住的肠腔内低氧环境。他们的“厌氧肠道芯片”在数天内稳定地维持了与人体粪便相类似的微生物多样性,并且通过人体肠道组织形成了一道保护性生理屏障。团队研究成果被发表在《自然·生物医学工程》(Nature Biomedical Engineering)期刊上。
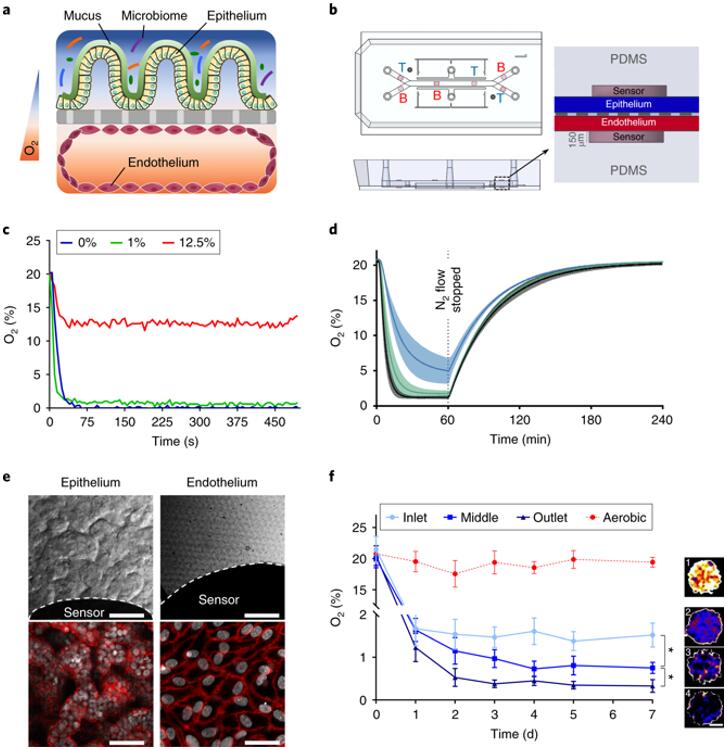
氧气敏感的人体肠道芯片微流控培养装置
Judah Folkman哈佛医学院(Harvard Medical School, HMS)血管生物学、波士顿儿童医院(Boston Children's Hospital)血管生物学项目教授,兼工程与应用科学学院生物工程系的教授Ingber博士指出,“过去十年来,医学领域的重要转变主要是认识到微生物组在健康和疾病中所起到的巨大作用。现在,这款新型厌氧性肠道芯片技术提供了一种在高度控制的体外环境下,在细胞和分子水平研究临床相关人体宿主和微生物组相互作用的方法。通过直接进入微生物组和分化的肠道组织,该方法可用于发现导致疾病或可能有助于预防这些疾病的特定微生物或其代谢物,并且,由于我们使用的是从患者身上分离的细胞,因此这种方法也适用于个性化医疗。”
论文第一作者Sasan Jalili-Firoozinezhad指出,“早期的组织培养系统旨在重现人体微生物组和体外肠上皮细胞之间的相互作用,但因无法使两种成分直接接触生长,且无法模拟对厌氧菌的生存至关重要的低氧浓度环境,因而可用性有限。” 他是威斯研究中心Ingber团队和论文共同作者,里斯本大学(University of Lisbon)Joaquim Cabral教授门下的研究生。更复杂的是,沿着小肠向结肠移动,氧气水平在不断下降,也改变了局部微生物组的组成。
针对这款厌氧肠道芯片,该团队利用了经过验证的,包含两个由多孔膜隔开的平行微通道肠道芯片。他们在上层通道的薄膜顶部培养人体肠上皮细胞,在下层通道薄膜的另一侧培养来自肠道微血管的血管内皮细胞。排列在肠道芯片上的肠道细胞来自细胞系或人体回肠活检,并通过中间类器官步骤扩增,形成微小的球形肠道组织结构,在放入芯片中进行培养之前,这些结构会被分解成碎片。
为了容纳一个完整的微生物组,该团队将肠道芯片放入定制设计的厌氧室内,使得研究人员能够显著降低上层肠上皮通道中的氧气浓度,同时保持下层内皮通道处于正常氧气浓度。Ingber团队的助理研究员,论文共同第一作者Elizabeth Calamari解释道,“我们在两个通道内生成氧气梯度,允许肠上皮细胞通过多孔膜扩散获得氧气支持。此外,我们为肠道芯片配备了光学传感器,能够实时报告两个通道中的局部氧气浓度,而不会干扰氧气梯度。” Elizabeth Calamari与威斯研究中心高级资深工程师,兼论文共同作者Richard Novak博士共同设计了这款器官芯片。
复杂的肠道微生物组样本来自健康人体的粪便,稳定培养在无菌小鼠体内,或从新鲜的婴儿粪便中分离出来,然后将其注入上层上皮通道内,它们与下层肠上皮细胞自然分泌的粘液层直接接触。更重要的是,在这种低氧条件下生长,共生细菌群的多样性维持了人体肠道中观察到的丰富性。Jalili-Firoozinezhad表示,“我们通过基因组分析证明了我们可以在数天内培养超过200种不同的细菌群,其丰富度和专性厌氧菌比例与在人类粪便中观察到的相类似。完整的微生物组进一步增强了肠道上皮的屏障功能,其细胞提供紧密密封并产生保护性粘液层,这是肠道健康的重要先决条件。”
能够在体外连续数天内观察与人体肠道组织直接接触的完整人类微生物组的组成和变化,为个性化医疗和药物测试提供了机会。论文共同第一作者,同时也是Ingber团队和论文共同作者,哈佛医学院免疫学专业教授Dennis Kasper门下的博士后Francesca Gazzaniga补充道,“我们可以培养来自相同个体的区域特异性肠道组织和微生物组,以找出对特定致病菌、炎症和全身性疾病产生敏感性或耐受性之间的关联。凭借这种厌氧肠道芯片,我们还可以在用药前,测试药物对人体微生物组的直接影响。”
论文链接:https://www.nature.com/articles/s41551-019-0397-0
延伸阅读:
相关热词搜索:器官芯片
上一篇:简化血细胞研究的微型离心机式微流控装置,解锁器官芯片新可能
下一篇:血液活检:新型微流控技术可以对癌细胞进行详细的遗传分析
